- Совет 1: Как вычислить равновесную концентрацию
- Инструкция
- Совет 2: Как вычислить начальные концентрации
- Инструкция
- Совет 3: Как обнаружить константу равновесия
- Инструкция
- Совет 4: Как вычислить концентрацию веществ
- Инструкция
- Совет 5: Как вычислить концентрацию
- Инструкция
- Совет 6: Как вычислить моляльную концентрацию
- Инструкция
- Совет 7: Как определить константу равновесия
- Инструкция
- Совет 8: Как выразить константу равновесия
- Инструкция
Совет 1: Как вычислить равновесную концентрацию
В ходе химической реакции устанавливается баланс, когда скорость прямой реакции (в ходе которой начальные вещества превращаются в продукты) становится равной скорости обратной реакции (когда продукты превращаются в начальные вещества). Концентрации всех этих веществ тогда именуются равновесными.

Инструкция
1. В первую очередь припомните, что такое константа баланса. Это – величина, характеризующая отношение концентраций (либо парциальных давлений) продуктов реакции к концентрациям начальных веществ. Скажем, если реакция протекает по схеме: А + В = С + D, то Кр = [C][D]/[A][B].
2. Если же схема протекания реакции такая: 2А + В = 2С, то Кр вычисляется по такой формуле:[C]^2/[B][A]^2. То есть индексы превращаются в показатель степени, в которую надобно построить концентрацию того либо другого компонента.
3. Разглядите пример. Представим, протекает та самая первая реакция: А + B = C + D. Требуется определить равновесные концентрации всех компонентов, если вестимо, что исходные концентрации начальных веществ А и В были равны 2 моль/литр, а константа баланса может быть принята за 1.
4. Вновь запишите формулу константы баланса для этого определенного случая: Кр = [C][D]/[A][B]. Рассматривая, что Кр = 1, получите: [C][D] = [A][B].
5. Исходные концентрации веществ А и В вам знамениты (заданы по условиям задачи). Исходные концентрации продуктов реакции С и D были равны 0, а потом увеличились до неких равновесных значений. Обозначьте равновесную концентрацию вещества С за х, тогда равновесная насыщенность вещества А (из которого образовалось С) будет равна (2-х).
6. От того что схема реакции свидетельствует, что из 1 моля вещества А образуется 1 моль вещества С, а из 1 моля вещества В – 1 моль вещества D, то, соответственно, равновесная насыщенность D также будет = х, а равновесная насыщенность В = (2-х).
7. Подставив эти величины в формулу, получите: (2-х) (2-х) = х^2. Решив это уравнение, получите: 4х = 4, то есть, х = 1.
8. Следственно, равновесные концентрации продуктов реакции C и D равны 1 моль/литр. Но от того что равновесные концентрации начальных веществ А и В вычисляются по формуле (2-х), то и они также будут равны 1 моль/литр. Задача решена.
Совет 2: Как вычислить начальные концентрации
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «начальные концентрации » – это концентрации веществ до начала протекания химической реакции, то есть перевоплощения их в другие вещества. Разумеется, такое реформирование сопровождается уменьшением их числа. Соответственно, снижаются и концентрации начальных веществ, вплотную до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в равнозначных числах.

Инструкция
1. Представим, перед вами поставлена дальнейшая задача. Протекала некая химическая реакция, в ходе которой начальные вещества, принятые как А и Б, превращались в продукты, скажем, условно В и Г. То есть реакция проходила по дальнейшей схеме: А + Б = В + Г. При концентрациях вещества Б равным 0,05 моль/л, а вещества Г – 0,02 моль/л, установилось некое химическое баланс. Нужно определить, какова исходная насыщенность веществ А0 и Б0, если константа баланса Кр равна показателю 0,04?
2. Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также припомните, что константа баланса Кр исчисляется по дальнейшей формуле: [В][Г]/[А][Б].
3. В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
4. Сейчас еще раз наблюдательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, исходную молярную концентрацию вещества А дозволено представить дальнейшим образом:А0 = x + 0,02 А0 = x + y
5. Припомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в будущем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда исходная насыщенность [A0] равна 0,2 + 0,02 = 0,22 моль/л.
6. А как быть с веществом Б? Его исходная насыщенность Б0 находится значительно проще. Для определения к равновесной концентрации этого вещества нужно прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Результат будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
Совет 3: Как обнаружить константу равновесия
Химическое равновесие — это состояние химической системы, когда скорость протекания прямой и обратной химической реакции равны. То есть состояние, при котором концентрации начальных веществ и продуктов реакции (либо их парциальные давления) не меняется. А константа равновесия Кр — это величина, определяющая соотношение между этими концентрациями, либо давлениями.

Инструкция
1. Возможен, вам необходимо рассчитать константу равновесия . Если речь идет о реакции между газами, продуктом которой также является газ, то константа равновесия рассчитывается через парциальные давления компонентов. Скажем, разглядите реакцию каталитического окисления диоксида серы до серного ангидрида (сырья для приобретения серной кислоты). Она протекает по дальнейшей схеме:2SO2 + O2 = 2SO^3.
2. С учетом показателей, стоящих перед молекулами диоксида серы и серного ангидрида, формула константы равновесия будет выглядеть дальнейшим образом:P^2 SO3/p^2 SO2 х pO2
3. Если реакция протекает в каком-нибудь растворе, и вам знамениты молярные концентрации начальных веществ и продуктов, то формула, по которой рассчитывается константа равновесия обратимой химической реакции А + Б = В + Г, будет дальнейшей:Кр = [A][Б]/[B][Г].
4. Вычислите константу равновесия химической реакции, применяя знаменитую величину метаморфозы энергии Гиббса (эти данные вы можете обнаружить в химических справочниках). Вычисление производится по дальнейшей формуле:?G = -RT lnKр, то есть lnKр = -?G/RT. Вычислив величину естественного логарифма Кр, вы без труда определите и саму величину константы равновесия .
5. При расчете константы равновесия , помните, что величина метаморфозы энергии Гиббса зависит лишь от финального и исходного состояния системы, а не от промежуточных этапов. Иными словами, вам абсолютно равнодушно, какими путями было получено финальное вещество из начального, метаморфоза энергии Гиббса все равно будет одним и тем же. Следственно, если вы по какой-то причине не можете определить ?G для определенной реакции, дозволено произвести расчеты по промежуточным реакциям (значимо лишь, дабы они в результате привели к образованию необходимого нам финального вещества).
Совет 4: Как вычислить концентрацию веществ
Насыщенность – это величина, показывающая, какое число вещества находится в определенной массе либо объеме газа, сплава либо раствора. Чем выше насыщенность, тем огромнее вещества там содержится. 100%-я насыщенность соответствует чистому веществу.

Инструкция
1. Представим, речь идет о сплаве. Скажем, бронза – сплав меди с оловом. Когда-то она имела такое значение, что в историю цивилизации вошла целая эра – «Бронзовый век». Выходит, у вас имеется бронзовая деталь весом 1 кг, отлитая из сплава, содержащего 750 г меди и 250 г олова. Требуется обнаружить концентрацию этих веществ.
2. Тут вам на поддержка придет представление «массовая доля», она же – «процентная насыщенность». Как легко дозволено осознать из самого наименования, она выражается величиной, характеризующей отношение массы компонента к всеобщей массе. 750/1000 = 0,75 (либо 75%) – для меди, 250/1000 = 0,25 (либо 25%) – для олова.
3. А как быть в случае раствора? Вот, скажем, классно знакомая вам пищевая сода – бикарбонат натрия, NaHCO3. Представим, 20 г этого вещества растворили в некотором числе воды. Взвесив сосуд с раствором, и вычтя массу самого сосуда, получили массу раствора – 150 г. Как дозволено вычислить концентрацию раствора бикарбоната натрия?
4. Во-первых, посчитайте его массовую долю (либо процентную концентрацию). Поделите массу вещества на всеобщую массу раствора: 20/150 = 0,133. Либо, переведите в проценты 0,133 * 100 = 13,3%.
5. Во-вторых, вы можете вычислить его молярную концентрацию, то есть посчитать, какое число молей бикарбоната натрия находилось бы в 1 литре такого раствора. Для начала вычислите, чему равен 1 моль этого вещества. Складывая ядерные веса элементов, входящих в состав молекулы бикарбоната натрия (и не забывая при этом об индексах), получите его молярную массу: 23 + 1 + 12 + 48 = 84 г/моль.
6. То есть, если бы в 1 литре раствора содержалось бы 84 грамма этого вещества, у вас был бы 1-молярный раствор. Либо, как принято записывать, 1М. А у вас – 20 грамм, к тому же в меньшем объеме. Рассматривая, что плотность воды равна 1, для облегчения расчетов примите, что объем раствора составляет 130 мл (130 г + 20 г = 150 г, по условиям задачи). Небольшим изменением объема при растворении соли дозволено пренебречь, погрешность будет незначительной.
7. 130 мл приблизительно в 7,7 раз поменьше, чем 1000 мл. Следственно, если бы в этом объеме содержалось 84/7,7 = 10,91 грамм бикарбоната натрия, это был бы 1М раствор. Но у вас 20 грамм вещества, следственно: 20/10,91 = 1,83М. Вот такова молярная насыщенность бикарбоната натрия в данном случае.
Полезный совет
Дозволено вычислить концентрацию, применяя также представления «мольная доля», «нормальность», «титр».
Совет 5: Как вычислить концентрацию
С представлением концентрации человек встречается не только в областях науки, но и в повседневной жизни. Скажем, массовая доля жира, указанная на продуктах питания (молоко, масло и т.д.) не что иное, как процентная насыщенность. Помимо нее есть еще молярная, типичная и моляльная концентрации. И всякую из них легко вычислить по формулам.

Вам понадобится
- – ручка;
- – бумага;
- – периодическая таблица;
- – калькулятор.
Инструкция
1. Дабы обнаружить массовую долю (процентную концентрацию ) того либо другого вещества, поделите его массу на всеобщую массу раствора (смеси). Итог получите в долях единицы, которые после этого можете пересчитать в проценты, что тоже будет правильно. Скажем, дана задача: для приготовления раствора взяли 150 г воды и 50 г сахара. Нужно вычислить процентную концентрацию растворенного вещества. Для решения вначале запишите формулу, а после этого обнаружьте желанную величину:? (сахара)= m(сахара)/m(раствора) = 50/ (150+50) =0,25 * 100% = 25%В растворе содержится 25% сахара.
2. При вычислении молярной концентрации, вы обязаны число вещества поделить на суммарный объем раствора. Единицей измерения, в данном случае, будет моль/л. Формула для расчета имеет дальнейший вид: C = n(растворенного вещества)/V, гдеC – молярная насыщенность (моль/л);n – число вещества (моль);V – суммарный объем смеси (литр).
3. Типичная насыщенность выражается в грамм-эквивалент/литр и обозначает число эквивалентов определенного вещества в 1 л раствора, которое равно, при химических реакциях, 1г водорода либо 8 г кислорода. Возможен вам нужно рассчитать нормальность 70% серной кислоты, плотность которой равна 1,615 г/л. Из данные задачи внятно, что 100 г раствора содержит 70 г кислоты. Следственно вначале обнаружьте объем данного раствора: V = 100/1,615 = 61,92 (мл). После этого рассчитайте массу H2SO4 в 1 литре раствора: m(H2SO4) = 1000*70/61,92 = 1130,49 (г). А потом вычислите нормальность, рассматривая при этом, что кислота является двухосновной:Cн = m*z/ M =1130,49*2/98 = 23,06 Н.
4. Если же вам требуется рассчитать моляльную концентрацию раствора (моляльность) – воспользуйтесь дальнейшей формулой: Cм = n/m, гдеCм – моляльная насыщенность измеряется в моль/кг;n – число определенного вещества в молях;m – суммарная масса раствора в килограммах.В различие от молярности моляльная насыщенность не зависит от температурных условий протекания реакции.
Полезный совет
В аналитической химии зачастую взамен концентрации применяют титр. Он показывает число определенного вещества в одном миллилитре раствора.
Совет 6: Как вычислить моляльную концентрацию
Молярная насыщенность – величина, которая показывает, сколько молей какого-нибудь вещества содержится в одном литре раствора. То есть это одна из разновидностей показателей концентрации. Зачастую появляется задача: посчитать молярную концентрацию того либо другого раствора.

Инструкция
1. Представим, у вас есть раствор объемом 300 миллилитров, содержащий 18 граммов натриевой селитры (то есть нитрата натрия либо натрия азотнокислого). Нужно вычислить его молярную концентрацию .
2. Припомните для начала, что формула этого вещества – NaNO3. А также, что численно молярная масса всякого вещества равна его молекулярной массе, отличаясь только размерностью. Посчитайте молекулярную массу нитрата натрия: 23 + 14 + 16*3 = 85 граммов/моль.
3. Следственно, если бы 85 граммов нитрата натрия содержалось в 1 литре раствора, это был бы одномолярный (1М) раствор данного вещества. Но у вас не 85, а 18 граммов, и объем раствора не 1000 миллилитров, а только 300. Произведите несложное вычисление: 18*1000/(85*300). Вы получите результат: 0,70588 М. Либо, округленно, 0,706 М. Вот такова молярная насыщенность имеющегося раствора нитрата натрия. Разумеется, если вам не необходима высокая точность, дозволено принять концентрацию даже за 0,7М.
4. Ну, а если данные задачи будут видоизменены? Вот, скажем, имеется 500 миллилитров 20%-го раствора классно знаменитого вам вещества – поваренной соли (она же – хлористый натрий). И требуется посчитать его молярную концентрацию . Как это сделать?
5. Тут тоже нет безусловно ничего трудного. Раньше каждого, припомните определение процентной концентрации. Это массовая доля, показывающая, сколько вещества содержится в всеобщей массе раствора либо расплава, либо смеси веществ. То есть для начала вам нужно установить массу имеющегося числа раствора. Заглянув в таблицу плотностей, вы увидите: ?20%-го раствора NaCl при комнатной температуре равна 1,1478 граммов/мл. То есть масса 500 мл 20%-го раствора составит: 500*1,1478 = 573,9 грамма. Либо, округленно, 574 грамма.
6. А дальше теснее все становится проще простого. 20% от 574 граммов составляют: 0,2*574 = 114,8 граммов – вот столько соли содержится в 500 мл раствора. Соответственно, в 1 литре такого раствора содержалось бы 229,6 грамма натрия хлористого. Если бы это был 1М раствор, то в 1 литре содержалось бы 58,5 грамма соли. То есть насыщенность вашего раствора составляет: 229,6/58,5 = 3,92 М. Задача решена.
Видео по теме
Совет 7: Как определить константу равновесия
Константа равновесия характеризует смещение обратимой химической реакции в сторону образования продуктов реакции либо начальных веществ. Вычислить константу равновесия дозволено разными методами, в зависимости от условий задачи.

Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор.
Инструкция
1. Константу равновесия дозволено выразить через равновесные концентрации участников реакции – то есть концентрации веществ в момент, когда скорость прямой реакции равна скорости обратной. Пускай дана обратимая реакция веществ А и В в определенных условиях с образованием вещества С: nА+mB ? zС, где n, m, z – показатели в уравнении реакций. Константу равновесия дозволено выразить: Kc = [C]^z/ ([A]^n*[B]^m), где [C], [A], [B] – равновесные концентрации веществ..
2. В первом типе задач требуется определить константу равновесия из равновесных концентраций веществ. Равновесные концентрации могут быть не заданы прямо. При их решении вначале запишите уравнение реакции, расставьте показатели.
3. Пример: монооксид азота при определенных условиях реагирует с кислородом c образованием NO2. Даны исходные концентрации веществ NO и O2 – 18 моль/л и 10 моль/л. Вестимо, что прореагировало 60% О2. Требуется обнаружить константу равновесия реакции.
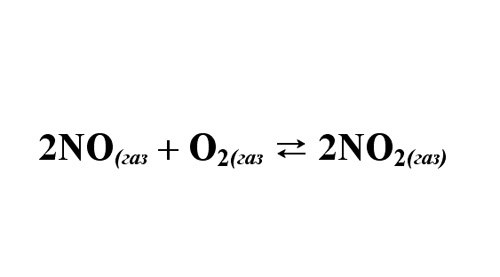
4. Запишите уравнение реакции, расставьте показатели. Обратите внимание, в каком соотношении реагируют вещества. Вычислите концентрацию O2, вступившего в реакцию: 10моль*0,6 = 6 моль/л. Из уравнения реакции обнаружьте концентрацию прореагировавшего NO – 12 моль/л. И концентрацию NO2 – 12 моль/л.
5. Определите число не вступившего в реакцию NO: 18-12 = 6 моль. И непрореагировавшего кислорода: 10-6 = 4 моль. Вычислите константу равновесия : Кc = 12^2/(6^2*4) = 1.
6. Если в условии задачи указаны константы скорости прямой и обратной реакции, обнаружьте константу равновесия из соотношения: K = k1/k2, где k1, k2 – константы скорости прямой и обратной химических реакций.
7. При изотермическом процессе и изобарном процессе константу равновесия дозволено обнаружить из уравнения стандартного метаморфозы энергии Гиббса: ?Gр-и = -RT*lnKc = -8,31T*2,3lgKc, где R – универсальная газовая непрерывная, равная 8,31; T – температура реакции, К; lnKc – естественный логарифм константы равновесия . Для комфорта его переводят в десятичный lgKc умножением на показатель 2,3.
8. Определить метаморфоза стандартной энергии Гиббса реакции, вы можете из уравнения для изотермического изобарного процесса: ?G = ?H – T ?S, где T – температура реакции, К; ?H – энтальпия, кДж/моль; ?S – энтропия, Дж/(моль-град). Значение энтальпии и энтропии для 1 моля основных химических соединений при температуре 25оС даны в справочной литературе. Если температура реакции отличается от 25оС, значения энтальпии и энтропии обязаны быть приведены в условии задачи.
9. Также величину ?G реакции при 25оС вы можете обнаружить, сложив потенциалы образования ?Gобр всего из продуктов реакции и вычтя из суммы ?Gобр начальных веществ. Значения потенциалов образования 25оС для 1 моля разных веществ приведены в справочных таблицах.
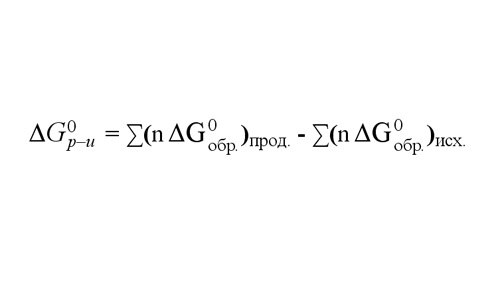
Обратите внимание!
В случае, если участники реакции находятся в различных агрегатных состояниях, в формулу для определения константы баланса входят концентрации веществ, находящихся в больше подвижном (газ либо жидкость) состоянии.
Совет 8: Как выразить константу равновесия
Выразить константу баланса дозволено по-различному. Все зависит от условий задачи. Эта величина характеризует смещение обратимой химической реакции в сторону образования начальных веществ либо определенных продуктов этой реакции.

Вам понадобится
- ручка, бумага, калькулятор
Инструкция
1. Выразите константу баланса через равновесные концентрации веществ, участвующих в реакции. Возьмите за начальную величину концентрации веществ в тот момент, когда скорость обратной и прямой реакции равны. Предположите, что в обратимую реакцию вступили вещества А и B. Реакция прошла в определенных условиях с образованием вещества С: nА+mB ? zС, где n, m, z – показатели в этом уравнении. Выразите константу дальнейшим образом: Kc = [C]^z/ ([A]^n*[B]^m), где [C], [A], [B] – концентрации веществ, находящиеся в равновесии.
2. Возьмите для изыскания изотермические и изобарные процессы. В этом случае выразите константу баланса с подмогой уравнения Гиббса: ?Gр-и = -RT*lnKc = -8,31T*2,3lgKc, где R – универсальная газовая непрерывная, равная 8,31; T – температура реакции, К; lnKc – естественный логарифм константы баланса. Для комфорта переведите его в десятичный lgKc. Для этого умножьте показатель на 2,3.
3. Определите стандартной энергии Гиббса для реакции. Дозволено сделать это, использовав уравнение для изотермического изобарного процесса: ?G = ?H – T ?S, где T – температура реакции, К; ?H – энтальпия, кДж/моль; ?S – энтропия, Дж/(моль-град). Обнаружьте в справочнике значение энтальпии и энтропии для 1 моля базовых химических соединений. Если реакция проходит при температуре, чудесной от 250C, непременно приведите значение этих величин в условии задачи.
4. Обнаружьте величину ?G реакции при температуре 250С. Для этого сложите потенциалы образования ?Gобр всего из полученных продуктов реакции. После этого вычтите из суммы ?Gобр начальных химических веществ. Обнаружьте значения потенциалов в справочнике.
5. Вычислите константу баланса в химической реакции газов, в итоге которой тоже получается газ. Она рассчитывается через парциальные давления компонентов.
6. Если реакция протекает в растворе с знаменитыми значениями молярных концентраций начальных веществ, то рассчитать константу дозволено по дальнейшей формуле: Кр = [A][Б]/[B][Г]. Это применимо к обратимой химической реакции А + Б = В + Г.
Обратите внимание!
Если участники реакции находятся в различных агрегатных состояниях, в формулу для определения константы баланса включите концентрации веществ, находящихся в больше подвижном (газ либо жидкость) состоянии.
Полезный совет
Равновесные концентрации могут быть не заданы прямо. При решении задач с таким условием вначале запишите уравнение реакции, расставьте показатели.









