Совет 1: Как рассчитать титр
Титр – это выражение концентрации раствора вещества, применяется в аналитической химии. Обозначает массу растворённого вещества в единице объёма раствора. Определить титр раствора в аналитической химии дозволено титриметрическим способом.

Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор;
- – Периодическая система химических элементов (таблица Менделеева).
Инструкция
1. При упомянутом способе измеряются объёмы 2-х вступивших между собой в реакцию растворов, один из которых – анализируемый, а 2-й – титрант либо титрованный раствор – с вестимой концентрацией. Для титранта существует представление условного титра либо титра по определяемому веществу. Это число анализируемого вещества, оттитрованного 1 мл раствора. В учебном курсе химии существуют несколько типов задач на расчет титра раствора.
2. В первом типе задач вам понадобится перевести концентрацию раствора из других единиц в титр. Насыщенность – это отношение величины растворенного вещества, заданной массой, числом молей, объёмом, к величине раствора либо растворителя. При решении опирайтесь на то, что для определения титра из начальных данных нужно получить массу растворенного вещества и величину объёма раствора, в котором оно находится.
3. Пример 1: определите титр 15% раствора серной кислоты. Плотность раствора 1,10 г/мл. Насыщенность раствора выражена в массовой доле вещества. Массовая доля – это отношение масс растворенного вещества и раствора. Рассчитайте массу одного литра раствора – 1100 грамм. Определите массовое оглавление серной кислоты в нём: 1100*0,15=165г. Вычислите титр раствора: 165 г/1000 мл=0,165 г/мл.
4. Пример 2: требуется обнаружить титр 0,15 н. раствора серной кислоты. Нормальность раствора – это число эквивалента растворенного вещества на литр раствора, единица – моль-экв/л. Эквивалент – это число вещества равнозначное 1 молю ионов водорода в химических реакциях. Один литр раствора содержит 0,15 моль эквивалента серной кислоты.
5. Пользуясь таблицей Менделеева, обнаружьте молярную массу H2SO4 – 98 г/моль. Эквивалент серной кислоты – 1/2. Вычислите молярную массу эквивалента H2SO4: 98/2=49 г/моль. Обнаружьте, сколько весят 0.15 моль эквивалента серной кислоты: 0,15*49=7,35 г. Определите титр раствора: 7,36 г/1000мл=0,00736 г/мл.
6. Во втором типе задач нужно обнаружить воображаемый титр. Для решения вычислите из начальных величин массу растворенного вещества и объём раствора, с которым оно прореагировало.
7. Пример 3: вычислите титр раствора 0,1 н. раствора AgNO3 по NaCl. Эквиваленты AgNO3 и NaCl равны единице. Обнаружьте молярную массу NaCl — 58,5г/моль. Обнаружьте число нитрата серебра в 1 мл раствора — 0,0001 моль. Следственно, число хлорида натрия, реагирующего с 1 мл раствора — 0,0001 моль. Умножьте молярную массу NaCl на количество вещества и получите воображаемый титр раствора нитрата серебра — 0,000585 г/мл — масса NaCl, реагирующая с 1мл раствора AgNO3.
8. 3-й тип задач – на вычисление титра раствора из значений, полученных титриметрическим способом. Для их решения опирайтесь на уравнение реакции обзора. Из него обнаружьте, в какой пропорции вещества взаимодействуют друг с ином.
9. Пример 4: определите титр раствора HCl, если на нейтрализацию 20 мл кислоты понадобилось 18 мл 0,13 н. раствора NaOH. Эквиваленты HCl и NaOH равны единице. Обнаружьте число хлорида натрия в 18 мл: 0,13*0,018=0,00234 моль. Следственно, число прореагировавшей соляной кислоты тоже будет 0,00234 моль. Вычислите молярную массу HCl – 36,5 г/моль. Обнаружьте массу полученного числа соляной кислоты: 0,00234*36,5=0,08541 г. Эта масса вещества содержится в 20 мл раствора. Обнаружьте титр раствора: 0,08541/20=0,0042705 г/мл.
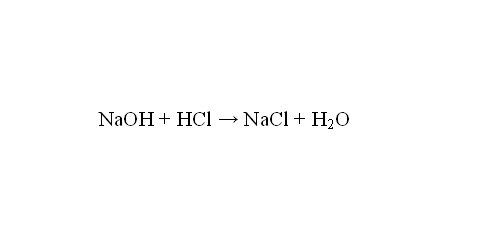
Совет 2: Как обнаружить титр раствора
Титр раствора – это один из терминов для обозначения концентрации (наравне с процентной концентрацией, молярной концентрацией и т.д.). Величина титра указывает, какое число граммов вещества содержится в одном миллилитре раствора .

Инструкция
1. Представим, дана такая задача. Имеется 20 миллилитров раствора гидроксида натрия. Для его нейтрализации потребовалось израсходовать 30 миллилитров 1М раствора соляной кислоты. Ни одно из веществ не было взято в избытке. Определить, каков титр щелочи.
2. Раньше каждого, напишите уравнение реакции. Она протекает так:NaOH + HCl = NaCl + H2O.
3. Вы видите, что в ходе этой реакции нейтрализации, согласно уравнению, число молей кислоты всецело совпадает с числом молей связанной ею щелочи. А сколько молей кислоты вступило в реакцию? Раз ее раствор одномолярный, то число молей будет во столько же раз поменьше единицы, во сколько раз 30 миллилитров поменьше 1 литра. То есть, 30/1000 = 0,03 моля.
4. Из этого следует, что щелочи также было 0,03 моля. Посчитайте, сколько это будет в граммах. Молекулярная масса резкого натра приблизительно равна 23 + 16 +1 = 40, следственно, его молярная масса составляет 40 г/моль. Умножив 40 на 0,03, получите: 1,2 грамма.
5. Ну, а дальше все дюже легко. 1,2 грамма щелочи содержится в 20 миллилитрах раствора . Поделив 1,2 на 20, получите результат: 0,06 грамм/миллилитр. Вот такой титр у раствора гидроксида натрия.
6. Усложним условие задачи. Представим, у вас имеется то же число раствора гидроксида натрия – 20 миллилитров. Для ее нейтрализации добавили те же 30 миллилитров 1М соляной кислоты. Впрочем, в различие от предыдущей задачи, оказалось, что кислота была взята в избытке, и для ее нейтрализации пришлось израсходовать 5 миллилитров 2М раствора гидроксида калия. Каков титр раствора гидроксида натрия в этом случае?
7. Начните с написания уравнения реакции кислоты с резким кали:HCl + KOH = KCl + H2O.
8. Рассуждая подобно вышеприведенному примеру и произведя расчеты, вы увидите: во-первых, первоначально соляной кислоты было 0,03 моля, а во-вторых, в реакцию с кислотой вступило 2х0,005 = 0,01 моля резкого кали. Эта щелочь, соответственно, связала 0,01 моля соляной кислоты. Следственно, на первую реакцию с иной щелочью – резким натром – ушло 0,03 – 0,01 = 0,02 моля соляной кислоты. Из чего становится ясно, что и резкого натра в растворе содержалось 0,02 моля, то есть, 40х0,02 = 0,8 грамм.
9. А дальше определить титр этого раствора – проще некуда, в одно действие. Поделив 0,8 на 20, получите результат: 0,04 грамма/миллилитр. Решение задачи заняло чуть огромнее времени, но и тут не было ничего трудного.




