- Совет 1: Как обнаружить число протонов и нейтронов
- Инструкция
- Совет 2: Как определить число нейтронов
- Инструкция
- Совет 3: Как обнаружить число нейтронов
- Инструкция
- Совет 4: Как обнаружить число протонов
- Инструкция
- Совет 5: Как вычислить число протонов в ядре изотопа
- Модель атома
- Изотопы и число протонов
- Примеры
Совет 1: Как обнаружить число протонов и нейтронов
Протоны и нейтроны, содержащиеся в ядерном ядре, называют нуклонами. От того что фактически каждая масса атома сконцентрирована в его ядре, то массовое число атома обозначает число нуклонов в ядре. С поддержкой периодической таблицы химических элементов Менделеева дозволено обнаружить число протонов и нейтронов. Для этого также дозволено применять другие методологии.
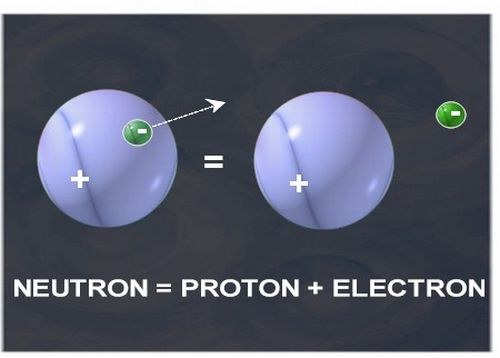
Вам понадобится
- — периодическая таблица химических элементов Менделеева;
- — заряд протона;
- — обозначения химических элементов.
Инструкция
1. Всякому атому вещества соответствует элемент периодической таблицы Менделеева. Обнаружьте такой элемент для атома, число протонов и нейтронов в ядре которого надобно обнаружить. Определите ядерную массу этого элемента. Она находится в нижней части ячейки, где размещен химический элемент. Если массовое число представлено дробным значением, округлите его до целых. Это число будет равно числу нуклонов в атоме. Скажем, определите ядерную массу магния. Обнаружьте данный элемент в периодической таблице, он имеет обозначение Mg. Его массовое число равно 24,305. Округлите его до целого и получите 24. Это значит, что число протонов и нейтронов (нуклонов) в ядре атома этого элемента равно 24.
2. Определите число протонов в ядре атома. Для этого обнаружьте его в периодической таблице химических элементов. В верхней части ячейки элемента подмечен его порядковый номер по счету в таблице. Это и есть число протонов в ядре атома исследуемого элемента. Скажем, порядковый номер магния (Mg) равен 12. Это значит, что в его ядре содержится 12 протонов.
3. Изредка вестим только заряд ядра в Кулонах, тогда, для того дабы обнаружить число протонов, поделите это число на заряд одного протона, тот, что равен 1,6022•10^-19 Кулона. Скажем, если знаменито, что заряд ядра составляет 35,2•10^-19 Кулона, то поделив его на 1,6022•10^-19 получите число , примерно равное 22. Это значит, что в ядре данного атома находится 2 протона.
4. Позже определения числа протонов обнаружьте число нейтронов в ядре. Для этого от относительной ядерной массы ядра, обнаруженной при помощи периодической таблицы химических элементов, отнимите число протонов, содержащихся в ядре. От того что помимо нейтронов других тяжелых частиц в ядре атома не содержится, это и будет число нейтронов. Скажем, если необходимо обнаружить число протонов и нейтронов в ядре фосфора (Р), обнаружьте его в периодической таблице, определите массовое число и порядковый номер элемента. Массовое число фосфора равно 30,97376?31, а порядковый номер 15. Это значит, что в ядре атома этого химического элемента содержится 15 протонов и 31-15=16 нейтронов.
Совет 2: Как определить число нейтронов
Атом химического элемента состоит из ядерного ядра и электронов. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, потому что протоны и нейтроны гораздо тяжелее электронов.

Вам понадобится
- атомный номер элемента, изотопы
Инструкция
1. В различие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Следственно, зная ядерный номер элемента, невозможно однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть как природными, так и полученными неестественно.
2. Ядерные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома, A = Z+N, где Z – заряд ядра (число протонов),а N – число нейтронов . Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий – два нейтрона (A = 3).
4. Связанность числа нейтронов от числа протонов отражена на N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Совет 3: Как обнаружить число нейтронов
Атом химического элемента состоит из ядерного ядра и электронной оболочки. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, так как протоны и нейтроны гораздо тяжелее электронов.

Вам понадобится
- атомный номер элемента, N-Z диаграмма.
Инструкция
1. Нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Это и представляет основную трудность при определении числа нейтронов – ядерный номер элемента либо его электронная оболочка не дают однозначного результата на данный вопрос. Скажем, в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть природными, а могут быть и получены неестественно.
2. Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома. A = Z+N, где Z – заряд ядра (число протонов), а N – число нейтронов. Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, что оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что дозволено увидеть в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий – два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
4. Связанность числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Совет 4: Как обнаружить число протонов
Дабы обнаружить число протонов в атоме, определите его место в таблице Менделеева. Обнаружьте его порядковый номер в периодической таблице. Он будет равен числу протонов в ядерном ядре. Если изучается изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно числу протонов. В том случае, если знаменит заряд ядерного ядра, дозволено узнать число протонов, поделив его значение на заряд одного протона.

Вам понадобится
- Для того дабы обнаружить число протонов, узнайте значение заряда протона либо электрона, возьмите таблицу изотопов, периодическую таблицу Менделеева.
Инструкция
1. Определение числа протонов знаменитого атома.В том случае, когда знаменито, какой атом изучается, обнаружьте его расположение в периодической таблице. Определите его номер в этой таблице, обнаружив ячейку соответствующего элемента. В данной ячейке обнаружьте порядковый номер элемента, тот, что соответствует постигаемому атому. Данный порядковый номер и будет соответствовать числу протонов в ядерном ядре.
2. Как обнаружить протоны в изотопе.Многие атомы имеют изотопы, отличающиеся массами ядер. Именно следственно только лишь массы ядра неудовлетворительно для однозначного определения ядерного ядра. При изложении изотопа перед записью его химического обозначения неизменно записывается пара чисел. Верхнее число показывает массу атома в ядерных единицах массы, а нижнее обозначает заряд ядра. Вся единица заряда ядра в такой записи соответствует одному протону. Таким образом, число протонов равно нижнему числу в записи данного изотопа.
3. Как обнаружить протоны, зная заряд ядра.Зачастую свойства атома характеризуется зарядом его ядра. Для того дабы определить число протонов в нем, нужно перевести его в кулоны (если он подан в кратных единицах). После этого поделите заряд ядра на модуль заряда электрона. Это связано с тем, что от того что атом электрически нейтрален, то число протонов в нем равно числу электронов. Причем заряды их равны по модулю и противоположны по знаку (протон имеет правильный заряд, электрон – негативный). Следственно заряд ядра атома поделите на число 1,6022•10^(-19) кулон. В итоге получится число протонов. От того что способы измерения заряда атома неудовлетворительно точны, в том случае, если при делении получилось дробное число, округлите его до целого.
Видео по теме
Совет 5: Как вычислить число протонов в ядре изотопа
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой правильно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа дозволено по ядерному номеру соответствующего химического элемента.
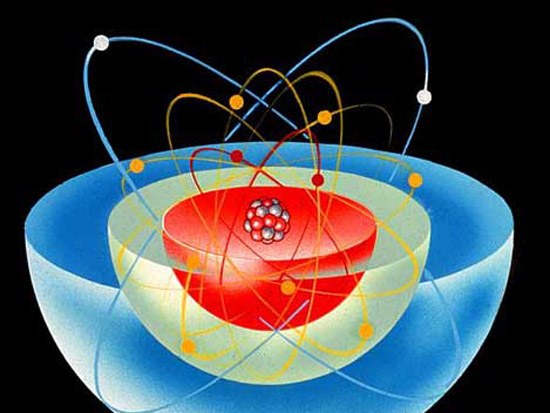
Модель атома
Для изложения свойств атома и его конструкции применяется модель, вестимая под наименованием «Модель атома по Бору». В соответствии с ней конструкция атома напоминает ясную систему — весомый центр (ядро) находится в центре, а больше легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют позитивно заряженное ядро, а негативно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в всем из них. Элементу присваивают свое имя и символ, скажем, водород (H) либо кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические колляции атома не зависят от числа нейтронов, потому что нейтроны не имеют электрического заряда. Впрочем их число влияет на устойчивость ядра, изменяя всеобщую массу атома.
Изотопы и число протонов
Изотопами называют атомы отдельных элементов с разным числом нейтронов. Данные атомы химически одинаковым, впрочем владеют различной массой, также они отличаются своей способностью испускать излучение.Ядерный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Весь атом характеризуется ядерным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре. Элемент может иметь атомы с разным числом нейтронов, но число протонов остается непоколебимым и равно числу электронов нейтрального атома. Для того, дабы определить, сколько протонов содержится в ядре изотопа, довольно посмотреть на его ядерный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
Примеры
В качестве примера дозволено разглядеть изотопы водорода. В природе особенно распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним либо двумя нейтронами, они имеют соответствующие наименования. Впрочем у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием либо тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его изредка называют сверхтяжелым водородом, а ядро трития — тритоном.










