Совет 1: Как составить формулы оксидов
Оксиды – это трудные химические вещества, которые состоят из 2-х элементов. Одним из них является кислород. Оксиды в большинстве случаев бывают кислотными и основными. Как легко осознать из наименования, кислотные оксиды реагируют с основаниями, образуя соль, то есть, проявляя свойства кислоты. Как составлять формулы оксидов ?

Инструкция
1. Многие из оксидов способны реагировать с водой, образуя кислоту. Скажем:SO3 + H2O = H2SO4 (образуется серная кислота).SiO2 + 2KOH = K2SiO3 + H2O (нерастворимый в воде оксид кремния вступает в реакцию с гидроксидом калия.
2. Основные оксиды, наоборот, вступают в реакции с кислотами, также образуя соль и воду. Те же из них, которые растворимы в воде, реагируют с ней, образуя основание. Характерные примеры:ZnO + 2HCl = ZnCl2 + H2O (нерастворимый в воде оксид цинка реагирует с соляной кислотой).Na2O + H2O = 2NaOH
3. Следует запомнить, что валентность кислорода в оксиде неизменно равняется 2. Исходя из этого, при составлении формулы нужно лишь знать валентность второго элемента. Скажем: щелочные металлы первой группы – одновалентные. Следственно всеобщая формула оксидов будет выглядеть так: Эл2О. Т.е., Li2O, Na2O, K2O, Rb2O. (Эл – «Элемент»).
4. Щелочноземельные металлы 2-й группы – двухвалентные. Всеобщая формула оксидов – ЭлО. И выглядеть она будет: ВеО, MgO, СаО, SrO.
5. Амфотерные элементы третьей группы, соответственно, трехвалентные. Всеобщая формула оксидов – Эл2О3. Классический пример – теснее упоминавшийся оксид алюминия Al2O3.
6. Элементы четвертой группы проявляют либо огромнее кислотных свойств (углерод, кремний), либо огромнее основных (германий, олово, свинец). В любом случае, всеобщая формула – ЭлО2 (СО2, SiO2).
7. Всеобщая формула пятой группы – Эл2О5. Пример – высший оксид азота, N2O5, из которого получают азотную кислоту. Либо высший оксид ванадия, V2О5 (правда ванадий – металл, его высший оксид проявляет кислотные свойства).
8. Соответственно, формула шестой группы, где находится сам кислород – ЭлО3. Высшие оксиды – SO3, СrO3, WO3. Обратите внимание, что хоть хром и вольфрам – металлы, их высшие оксиды по аналогии с оксидом ванадия также проявляют кислотные свойства.
9. Следует уточнить, что указывались лишь высшие оксиды элементов. Так, скажем, помимо оксида хрома CrО3, где хром шестивалентен, есть оксид Cr2O3, где данный элемент имеет валентность, равную 3. Помимо оксида азота N2O5, существуют оксиды N2O, NO, NO2. Сходственных примеров дюже много. Следственно, при написании формулы оксида, проверяйте, какую валентность имеет в этом соединении элемент, объединенный с кислородом!
Совет 2: Как составить формулу вещества
Вам нужно составить химическую формулу , но вы безусловно позабыли основы школьной химии? Поверьте, не стоит переживать. На сегодняшний день вестимо больше 20 миллионов химических соединений, и, поверьте, никто не держит их формулы у себя в голове. Довольно знать легкой правило их написания.
Вам понадобится
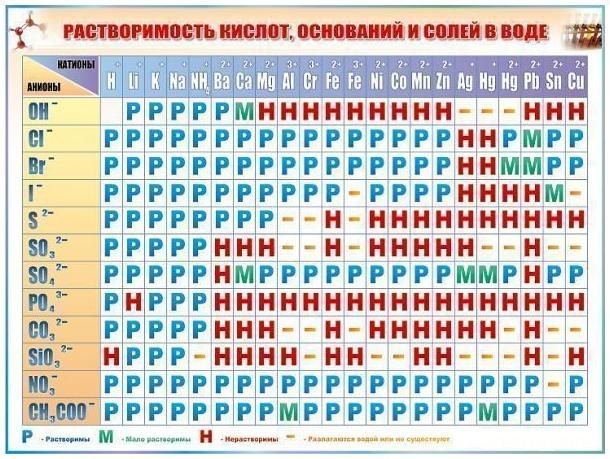
- периодическая таблица Менделеева, таблица растворимости солей
Инструкция
1. Задача составления химической формулы вещества сводится к созданию электронейтральной системы. Следственно вам нужно будет подобрать некоторое число электронов для всего элемента соединения так, дабы оно было уравновешено.Впрочем перед тем, как это сделать, вам следует припомнить некоторые теоретические основы. Всякий элемент периодической таблицы Менделеева владеет своей валентностью (степенью окисления), то есть способностью отдавать либо принять некоторое число электронов, с учетом своей валентности, не больше восьми электронов. Валентность всего химического элемента соответствует номеру группы в периодической таблице (верхняя строка, написанная римскими цифрами). Стоит подметить, что все элементы таблицы Менделеева дозволено условно поделить на два класса: окислители и восстановители. Первые, как водится, только забирают электроны, вторые – отдают.
2. Для составления химической формулы также нужно знать, с каким типом соединений вы имеете дело. Их дозволено поделить на следующие группы:1. Бинарные;2. Основания, соли, кислоты.
3. Для составления формулы бинарных соединений вам понадобится таблица Менделеева, а для остальных групп – таблица растворимости солей. В формулах бинарных соединений на первом месте принято писать металл либо элемент с меньшей валентностью, на втором – неметалл либо элемент с большей валентностью. Возможен, нужно составить формулу оксида тантала. Запишите рядом обозначения этих элементов и проставьте их валентность: Та5О6. Тантал, соответственно, горазд отдать 3 электрона, а кислород – принять два, то есть: Та3+О2-. Таким образом, для создания уравновешенной системы способом «крест-на-крест» (меняя индексы химических элементов местами и отбрасывая их знаки) вы получаете следующую формулу : Та2О3.
4. Для составления формул оснований, солей и кислот нужно воспользоваться таблицей растворимости солей. В верхней ее строке указаны катионы – вещества , отдающие электроны, а в левом столбце – анионы, то есть соединения, способные принимать электроны. Пользуясь таблицей растворимости солей, дозволено получить следующую формулу для сульфата алюминия: Al3+ SO42-. Применяя тезис «крест-на-крест», окончательная формула вещества будет иметь вид: Аl2(SO4)3.Как видите, алгорифм составления химических формул дюже примитивен. Он остается непоколебимым для всяких других соединений.
Совет 3: Что такое оксиды, гидроксиды и соли
Одними из основных в химии являются 2 представления: «примитивные вещества» и «трудные вещества». Первые образованы атомами одного химического элемента и подразделяются на неметаллы и металлы. Оксиды, гидроксиды, соли – это классы трудных веществ, либо химических соединений, состоящих из атомов различных химических элементов.

Оксиды
Это трудные химические вещества, бинарные по составу, потому что состоят из 2-х компонентов, один из которых кислород в степени окисления -2. Номенклатура строится из слова «оксид» и наименования элемента, тот, что входит в состав это вещества. По химическим свойствам могут быть солеобразующими и индифферентными (не образующими соли). К первым дозволено отнести кислотные (оксиды фосфора, серы, углерода), основные (кальция, меди) либо амфотерные (цинка, алюминия). Индифферентные оксиды не проявляют упомянутые выше свойства и ранее именовались равнодушными. Впрочем они тоже могут вступать в химические реакции. Среди таких оксидов, скажем, оксиды азота.Множество кислотных оксидов представлены газами, некоторые жидкостями, в их составе неметаллы. А вот основные почаще твердые вещества, кристаллической конструкции, состоят из кислорода и металла. Самый общеизвестный из оксидов – это вода.Химические свойства: вступают в реакции с кислотами, гидроксидами и водой.
Гидроксиды
К ним относят неорганические вещества, имеющие в составе –ОН (гидроксильную) группу. По систематизации схожи с оксидами и делятся в зависимости от химических свойств на кислотные, основные и амфотерные. Растворимые в воде гидроксиды называют щелочами, они имеют самый низкий рН и состоят из одновалентного металла и –ОН-группы. С увеличением числа гидрокси-групп и валентностью металла растворимость падает, а значение рН возрастает.По физическим свойствам гидроксиды твердые. Использование гидроксидам находят в производстве сообщи, аккумуляторов, мыла. К примеру, при применении КОН мыло будет жидким, а если взять NaOH, то твердым. Химические свойства: с кислотами образуют соли, с солями же реагируют только при летучести либо нерастворимости продукта.
Соли
Это также трудные соединения, в их состав включены атом металла и кислотный остаток. Образуются они реакциями нейтрализации (взаимодействие кислоты и основания с приобретение соли и воды). Если в молекуле кислоты один из ионов водорода замещен на металл, то соль считается кислой, а если это происходит с гидрокси-группой, то соль основная. По физическим свойствам они твердые кристаллические вещества.Самая вестимая соль – NaCl. Используется фактически повсюду в пищевой промышленности и является неотделимой частью рациона человека.Химические свойства: взаимодействуют с крепкими кислотами, со щелочами образуют нерастворимую соль либо основание, больше мощные металлы (в электрохимическом ряду) вытесняют из них слабый металл, при нерастворимости одного из продуктов соли реагируют с солями.